UNS
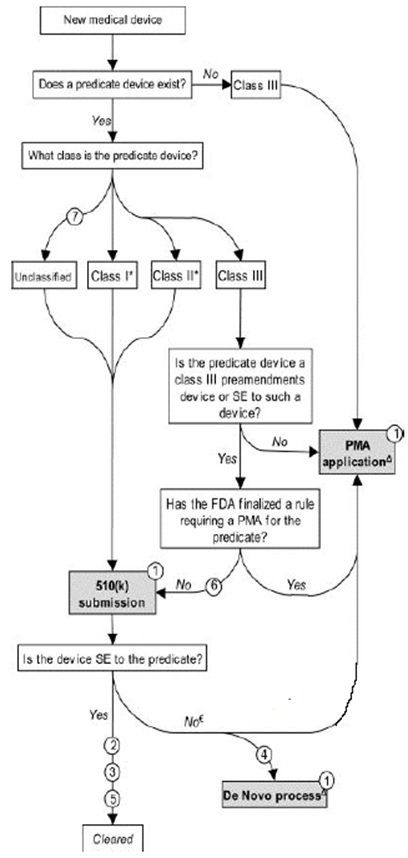
Einer der ersten Schritte beim Verkauf eines medizinischen Geräts der Klasse II oder IVD in den Vereinigten Staaten ist die Einreichung einer Vormarktbenachrichtigung bei der FDA, die auch als FDA 510 (k) -Einreichung bekannt ist. Technisch "genehmigt" die FDA keine medizinischen Geräte oder IVDs, die unter dem 510 (k) -Verfahren verkauft werden sollen; Die Agentur gibt eine "Freigabe" für den Verkauf in den USA. Wir verwenden die Begriffe "FDA-Zulassung" und "FDA-Zulassung" austauschbar.
510 (k)
A 510 (k) ist eine Vorabmitteilung von Medizinprodukten an die US-amerikanische FDA. Die Zahl „510“ bezieht sich auf einen Abschnitt des Lebensmittel-, Arzneimittel- und Kosmetikgesetzes. „K“ ist der Unterabschnitt, der für die Benachrichtigung vor dem Inverkehrbringen spezifisch ist. Einzelheiten, die den Prozess regeln, finden sich jedoch in 21 CFR 807. Etwa 80 Prozent aller medizinischen Geräte sind durch das Vormarkierungsbenachrichtigungsprogramm der FDA 510 (k) geschützt. Im Rahmen des 510 (k) -Programms "genehmigt" die FDA keine medizinischen Geräte. Stattdessen werden sie auf dem Markt zum Verkauf „freigegeben“, was eine weniger strenge Überprüfung als die im Rahmen des PMA-Programms geforderte impliziert. Das 510 (k) -Überprüfungsprogramm verlangt jedoch weiterhin, dass Gerätehersteller umfangreiche Unterlagen vorlegen müssen, die die weitgehende Gleichwertigkeit (SE) ihrer Geräte bei anderen gesetzlich vermarkteten medizinischen Geräten vorlegen, die zuvor von der FDA genehmigt wurden (als „Prädikatprodukte“ bezeichnet).
Wesentliche Gleichwertigkeit:
A 510 (k) erfordert den Nachweis der wesentlichen Gleichwertigkeit mit einem anderen legal in den USA vertriebenen Gerät. Wesentliche Gleichwertigkeit bedeutet, dass das neue Gerät mindestens so sicher und wirksam ist wie das Prädikat.
Ein Gerät ist im Wesentlichen gleichwertig, wenn es im Vergleich zu einem Vergleichselement
• hat den gleichen Verwendungszweck wie das Prädikat; und
• hat die gleichen technologischen Eigenschaften wie das Prädikat;
oder
• hat den gleichen Verwendungszweck wie das Prädikat; und
• weist unterschiedliche technologische Merkmale auf und wirft keine unterschiedlichen Fragen der Sicherheit und Wirksamkeit auf. und
• Die an die FDA übermittelten Informationen zeigen, dass das Gerät mindestens so sicher und wirksam ist wie das legal vermarktete Gerät.
Ein Anspruch auf substantielle Gleichwertigkeit bedeutet nicht, dass die neuen und Prädikatgeräte identisch sein müssen. Eine wesentliche Äquivalenz wird in Bezug auf beabsichtigte Verwendung, Design, verwendete oder gelieferte Energie, Materialien, chemische Zusammensetzung, Herstellungsprozess, Leistung, Sicherheit, Wirksamkeit, Kennzeichnung, Biokompatibilität, Normen und andere Merkmale, sofern zutreffend, festgestellt.
Die obligatorischen Elemente von 510 (k) umfassen (unter anderem):
1. Eine ausreichend detaillierte Beschreibung der Vorrichtung, die die Bestimmung der wesentlichen Gleichwertigkeit ermöglicht.
2. Eine Identifikation des Prädikats, für die eine wesentliche Äquivalenz beansprucht wird.
3. Eine Erläuterung der bestimmungsgemäßen Verwendung des Geräts. Wenn diese Erklärungen vom Prädikat abweichen, muss eine zusätzliche Erklärung bereitgestellt werden, in der beschrieben wird, warum diese Unterschiede keinen Einfluss auf die Sicherheit und Wirksamkeit des Geräts haben.
4. Wenn das Gerät die gleichen technologischen Eigenschaften wie das Prädikat hat, muss eine Zusammenfassung bereitgestellt werden, in der die technologischen Merkmale des neuen Geräts mit dem Prädikat verglichen werden. Wenn das Gerät unterschiedliche technologische Merkmale aufweist, muss eine Zusammenfassung bereitgestellt werden, in der erläutert wird, in welcher Weise die technologischen Merkmale den Eigenschaften des Prädikats ähnlich sind.
510 (k) Typen:
1) Besonderes: Für geänderte Geräte innerhalb von 30 Tagen nach Einreichung bearbeitet. Der Special 510 (k) wird für Gerätemodifikationen verwendet und nutzt den Aspekt der Designkontrolle der QS-Verordnung (21 CFR 820.30). Spezielle 510 (k) s können zur Änderung eines Geräts eingereicht werden, das im Rahmen des 510 (k) -Prozesses freigegeben wurde. Wenn ein neuer 510 (k) für die Modifikation benötigt wird und die Modifikation die beabsichtigte Verwendung des Geräts nicht beeinflusst oder die grundlegende wissenschaftliche Technologie des Geräts ändert, kann eine zusammenfassende Information, die sich aus dem Entwurfssteuerungsprozess ergibt, als Basis dienen um die Anwendung zu löschen.
2) Abkürzung: Gerätehersteller können sich entscheiden, eine Abkürzung 510 (k) einzureichen, wenn:
• eine Anleitung existiert,
• eine besondere Kontrolle eingerichtet wurde oder
• Die FDA hat einen relevanten Konsensstandard anerkannt.
3) Traditionell: Das Traditionelle 510 (k) kann für jedes Original 510 (k) oder für eine Modifikation an einem zuvor gelöschten Gerät unter 510 (k) verwendet werden.
Wesentliche Gleichwertigkeit:
A 510 (k) erfordert den Nachweis der wesentlichen Gleichwertigkeit mit einem anderen legal in den USA vertriebenen Gerät. Wesentliche Gleichwertigkeit bedeutet, dass das neue Gerät mindestens so sicher und wirksam ist wie das Prädikat.
Ein Gerät ist im Wesentlichen gleichwertig, wenn es im Vergleich zu einem Vergleichselement
• hat den gleichen Verwendungszweck wie das Prädikat; und
• hat die gleichen technologischen Eigenschaften wie das Prädikat;
oder
• hat den gleichen Verwendungszweck wie das Prädikat; und
• weist unterschiedliche technologische Merkmale auf und wirft keine unterschiedlichen Fragen der Sicherheit und Wirksamkeit auf. und
• Die an die FDA übermittelten Informationen zeigen, dass das Gerät mindestens so sicher und wirksam ist wie das legal vermarktete Gerät.
Ein Anspruch auf substantielle Gleichwertigkeit bedeutet nicht, dass die neuen und Prädikatgeräte identisch sein müssen. Eine wesentliche Äquivalenz wird in Bezug auf beabsichtigte Verwendung, Design, verwendete oder gelieferte Energie, Materialien, chemische Zusammensetzung, Herstellungsprozess, Leistung, Sicherheit, Wirksamkeit, Kennzeichnung, Biokompatibilität, Normen und andere Merkmale, sofern zutreffend, festgestellt.
Die obligatorischen Elemente von 510 (k) umfassen (unter anderem):
1. Eine ausreichend detaillierte Beschreibung der Vorrichtung, die die Bestimmung der wesentlichen Gleichwertigkeit ermöglicht.
2. Eine Identifikation des Prädikats, für die eine wesentliche Äquivalenz beansprucht wird.
3. Eine Erläuterung der bestimmungsgemäßen Verwendung des Geräts. Wenn diese Erklärungen vom Prädikat abweichen, muss eine zusätzliche Erklärung bereitgestellt werden, in der beschrieben wird, warum diese Unterschiede keinen Einfluss auf die Sicherheit und Wirksamkeit des Geräts haben.
4. Wenn das Gerät die gleichen technologischen Eigenschaften wie das Prädikat hat, muss eine Zusammenfassung bereitgestellt werden, in der die technologischen Merkmale des neuen Geräts mit dem Prädikat verglichen werden. Wenn das Gerät unterschiedliche technologische Merkmale aufweist, muss eine Zusammenfassung bereitgestellt werden, in der erläutert wird, in welcher Weise die technologischen Merkmale den Eigenschaften des Prädikats ähnlich sind.
510 (k) Typen:
1) Besonderes: Für geänderte Geräte innerhalb von 30 Tagen nach Einreichung bearbeitet. Der Special 510 (k) wird für Gerätemodifikationen verwendet und nutzt den Aspekt der Designkontrolle der QS-Verordnung (21 CFR 820.30). Spezielle 510 (k) s können zur Änderung eines Geräts eingereicht werden, das im Rahmen des 510 (k) -Prozesses freigegeben wurde. Wenn ein neuer 510 (k) für die Modifikation benötigt wird und die Modifikation die beabsichtigte Verwendung des Geräts nicht beeinflusst oder die grundlegende wissenschaftliche Technologie des Geräts ändert, kann eine zusammenfassende Information, die sich aus dem Entwurfssteuerungsprozess ergibt, als Basis dienen um die Anwendung zu löschen.
2) Abkürzung: Gerätehersteller können sich entscheiden, eine Abkürzung 510 (k) einzureichen, wenn:
• eine Anleitung existiert,
• eine besondere Kontrolle eingerichtet wurde oder
• Die FDA hat einen relevanten Konsensstandard anerkannt.
3) Traditionell: Das Traditionelle 510 (k) kann für jedes Original 510 (k) oder für eine Modifikation an einem zuvor gelöschten Gerät unter 510 (k) verwendet werden.
Wir unterstützen auch Premarket Application (PMA) für Geräte der Klasse 3