NOUS
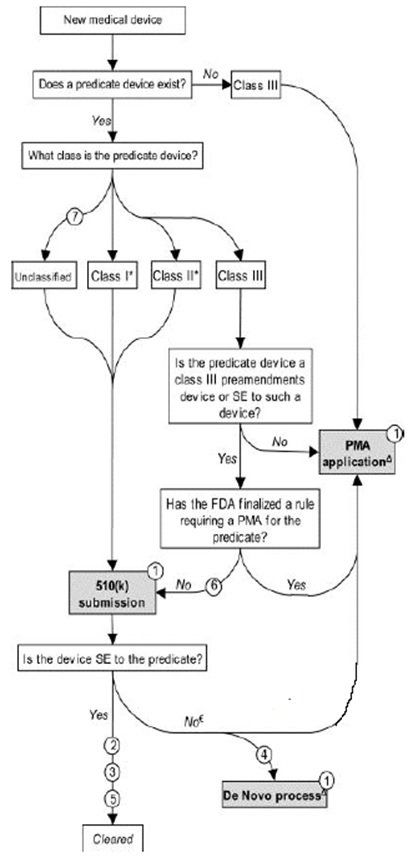
L'une des premières étapes vers la vente d'un dispositif médical de classe II ou d'un dispositif de diagnostic in vitro aux États-Unis consiste à déposer auprès de la FDA une notification de précommercialisation, également connue sous le nom de soumission FDA 510 (k). Techniquement, la FDA n’approuve pas la vente de dispositifs médicaux ou de DIV sous le processus 510 (k); L'agence donne "l'autorisation" de les vendre aux États-Unis. Les termes "approbation de la FDA" et "autorisation de la FDA" sont utilisés de manière interchangeable.
510 (k)
Un 510 (k) est une notification préalable à la commercialisation des dispositifs médicaux à la FDA des États-Unis. Le nombre «510» fait référence à l'article de la loi sur les aliments, drogues et cosmétiques. «K» est la sous-section spécifique à la notification préalable à la mise en marché. Les détails régissant le processus, cependant, se trouvent dans 21 CFR 807. environ 80% de tous les dispositifs médicaux sont couverts par le programme de notification de précommandes 510 (k) de la FDA. Dans le cadre du programme 510 (k), la FDA n’approuve pas réellement les dispositifs médicaux. Au lieu de cela, il les «vend» sur le marché, ce qui implique un examen moins rigoureux que celui requis dans le cadre du programme PMA. Cependant, le programme de révision 510 (k) exige toujours que les fabricants d’appareils soumettent une documentation complète à l’appui de l’équivalence substantielle (ES) de leurs appareils par rapport à d’autres appareils médicaux commercialisés légalement, préalablement approuvés par la FDA (ci-après dénommés «appareils prédicats»).
Équivalence substantielle:
Un 510 (k) nécessite la démonstration d’une équivalence substantielle avec un autre dispositif commercialisé légalement aux États-Unis. Une équivalence substantielle signifie que le nouveau périphérique est au moins aussi sûr et efficace que le prédicat.
Un dispositif est sensiblement équivalent si, par rapport à un prédicat, il:
• a la même utilisation que le prédicat; et
• a les mêmes caractéristiques technologiques que le prédicat;
ou
• a la même utilisation que le prédicat; et
• présente des caractéristiques technologiques différentes et ne pose pas différentes questions de sécurité et d’efficacité; et
• les informations transmises à la FDA démontrent que le dispositif est au moins aussi sûr et efficace que le dispositif légalement commercialisé.
Une revendication d'équivalence substantielle ne signifie pas que les nouveaux dispositifs et les prédicats doivent être identiques. Une équivalence substantielle est établie en ce qui concerne l'utilisation prévue, la conception, l'énergie utilisée ou livrée, les matériaux, la composition chimique, le procédé de fabrication, les performances, la sécurité, l'efficacité, l'étiquetage, la biocompatibilité, les normes et autres caractéristiques, le cas échéant.
Les éléments obligatoires d’un 510 (k) incluent (entre autres):
1. Une description suffisamment détaillée du dispositif, permettant de déterminer une équivalence substantielle.
2. Une identification du dispositif prédicat, pour lequel une équivalence substantielle est revendiquée.
3. Une explication de l'utilisation prévue de l'appareil. Lorsque ces explications diffèrent de celles du prédicat, une explication supplémentaire doit être fournie, expliquant pourquoi ces différences n'auront aucune influence sur la sécurité et l'efficacité du dispositif.
4. Si le dispositif présente les mêmes caractéristiques technologiques que le prédicat, vous devez fournir un résumé dans lequel les caractéristiques technologiques du nouveau dispositif sont comparées au prédicat. Si le dispositif présente des caractéristiques technologiques différentes, vous devez fournir un résumé expliquant en quoi les caractéristiques technologiques sont similaires aux caractéristiques du prédicat.
510 types (k):
1) Spécial: Pour les appareils modifiés, traité dans les 30 jours suivant la soumission. Le Special 510 (k) est utilisé pour les modifications d'appareils et utilise l'aspect des contrôles de conception de la régulation du système qualité (QS) (21 CFR 820.30). Des 510 (k) spéciaux peuvent être soumis pour modification à un périphérique qui a été libéré en vertu du processus 510 (k). Si un nouveau 510 (k) est nécessaire pour la modification et si la modification n'affecte pas l'utilisation prévue de l'appareil ni ne modifie la technologie scientifique fondamentale de celui-ci, les informations résumées résultant du processus de contrôle de la conception peuvent servir de base. pour effacer l'application.
2) Abrégé: Les fabricants d’appareils peuvent choisir de soumettre un abrégé 510 (k) lorsque:
• un document d'orientation existe,
• un contrôle spécial a été établi, ou
• La FDA a reconnu une norme consensuelle pertinente.
3) Traditionnel: Le modèle traditionnel 510 (k) peut être utilisé pour n’importe quel modèle original 510 (k) ou pour modifier un périphérique précédemment effacé sous le numéro 510 (k).
Équivalence substantielle:
Un 510 (k) nécessite la démonstration d’une équivalence substantielle avec un autre dispositif commercialisé légalement aux États-Unis. Une équivalence substantielle signifie que le nouveau périphérique est au moins aussi sûr et efficace que le prédicat.
Un dispositif est sensiblement équivalent si, par rapport à un prédicat, il:
• a la même utilisation que le prédicat; et
• a les mêmes caractéristiques technologiques que le prédicat;
ou
• a la même utilisation que le prédicat; et
• présente des caractéristiques technologiques différentes et ne pose pas différentes questions de sécurité et d’efficacité; et
• les informations transmises à la FDA démontrent que le dispositif est au moins aussi sûr et efficace que le dispositif légalement commercialisé.
Une revendication d'équivalence substantielle ne signifie pas que les nouveaux dispositifs et les prédicats doivent être identiques. Une équivalence substantielle est établie en ce qui concerne l'utilisation prévue, la conception, l'énergie utilisée ou livrée, les matériaux, la composition chimique, le procédé de fabrication, les performances, la sécurité, l'efficacité, l'étiquetage, la biocompatibilité, les normes et autres caractéristiques, le cas échéant.
Les éléments obligatoires d’un 510 (k) incluent (entre autres):
1. Une description suffisamment détaillée du dispositif, permettant de déterminer une équivalence substantielle.
2. Une identification du dispositif prédicat, pour lequel une équivalence substantielle est revendiquée.
3. Une explication de l'utilisation prévue de l'appareil. Lorsque ces explications diffèrent de celles du prédicat, une explication supplémentaire doit être fournie, expliquant pourquoi ces différences n'auront aucune influence sur la sécurité et l'efficacité du dispositif.
4. Si le dispositif présente les mêmes caractéristiques technologiques que le prédicat, vous devez fournir un résumé dans lequel les caractéristiques technologiques du nouveau dispositif sont comparées au prédicat. Si le dispositif présente des caractéristiques technologiques différentes, vous devez fournir un résumé expliquant en quoi les caractéristiques technologiques sont similaires aux caractéristiques du prédicat.
510 types (k):
1) Spécial: Pour les appareils modifiés, traité dans les 30 jours suivant la soumission. Le Special 510 (k) est utilisé pour les modifications d'appareils et utilise l'aspect des contrôles de conception de la régulation du système qualité (QS) (21 CFR 820.30). Des 510 (k) spéciaux peuvent être soumis pour modification à un périphérique qui a été libéré en vertu du processus 510 (k). Si un nouveau 510 (k) est nécessaire pour la modification et si la modification n'affecte pas l'utilisation prévue de l'appareil ni ne modifie la technologie scientifique fondamentale de celui-ci, les informations résumées résultant du processus de contrôle de la conception peuvent servir de base. pour effacer l'application.
2) Abrégé: Les fabricants d’appareils peuvent choisir de soumettre un abrégé 510 (k) lorsque:
• un document d'orientation existe,
• un contrôle spécial a été établi, ou
• La FDA a reconnu une norme consensuelle pertinente.
3) Traditionnel: Le modèle traditionnel 510 (k) peut être utilisé pour n’importe quel modèle original 510 (k) ou pour modifier un périphérique précédemment effacé sous le numéro 510 (k).
Nous prenons également en charge les applications prémarchés (PMA) pour les appareils de classe 3